Stickstoff – inertes Gas oder vielseitiges Element?
Die Luft besteht zu über 78 Prozent aus Stickstoff, einem recht reaktionsträgen Gas. Doch benötigen alle Lebewesen Stickstoff beim Aufbau von Aminosäuren und mithin allen Proteinen. Daher wurde schon früh untersucht, wie der Stickstoff aus der Luft in reaktivere Verbindungen überführt werden kann. Aktuell werden neue Reaktionen des Stickstoffs erforscht, bei denen Stickstoffatome zu langen Kettenmolekülen verknüpft werden.
- Fachwissen
- Schuljahr 10-12
Im internationalen Jahr des Periodensystems gilt der erste Blick der Stellung eines Elements im Periodensystem. Stickstoff ist das erste Element in der fünften Hauptgruppe, darunter befindet sich der, bei Raumtemperatur feste, Phosphor, gefolgt von Arsen, Antimon und Bismut. Als Element der zweiten Periode umgeben den Atomkern fünf Elektronen in der Außenhülle, die mit anderen Elementen Einfach- bis Dreifachbindungen eingehen.
Elementar kommt Stickstoff (N2) als Gas vor. Wichtige Verbindungen sind die Basen, wie Ammoniak (NH3), und Salze, die sich von der Salpetersäure (HNO3) ableitenden. Ende des 18. Jahrhunderts experimentierte der englische Apotheker Humphry Davy mit der narkotisierenden Wirkung von Lachgas (N2O). Im menschlichen Körper ist Stickstoffmonoxid (NO) ein wichtiger Botenstoff. Abgesehen von der ätzenden Wirkung der Säure sind auch die Stickoxide bereits in geringen Dosen gesundheitsschädlich. Hingegen unschädlich ist der Harnstoff (CO(NH2)2), die Form in der Stickstoff über den Urin ausgeschieden wird.
Die Entdeckung des Stickstoffs gelang im Jahr 1722 gleich mehreren Forschern, wobei der schottische Botaniker Daniel Rutherford die elementare Form erkannte. Da reiner Stickstoff im Gegensatz zum Gasgemisch Luft erstickend ist, ergab sich der deutsche Name. Das Gas ist reaktionsträge und nicht brennbar, allerdings aktivieren hohe Temperaturen die Reaktionsfähigkeit. Sehr viel effizienter in ihrer katalytischen Wirkung sind jedoch Enzyme von Mikroorganismen, die es ermöglichen, das Gas aus der Luft aufzunehmen und chemisch zu binden.
Stickstoff – aus der Luft gegriffen
Die Reaktionsgleichung zur Bildung von Ammoniak sieht schlicht aus:
N2 + 3 H2 ⇄ 2 NH3
Dabei sind für die technischen Verfahren unter anderem hohe Drücke vonnöten. Unter natürlichen Bedingungen gelingt die Reaktion den gerade erwähnten Mikroorganismen, die beispielsweise vergesellschaftet mit Pflanzen leben. So bilden Schmetterlingsblütler (Leguminosen) wie Erbsen, Bohnen, Lupinen und Wicken an ihren Wurzeln ein lockeres Gewebe aus und in diesen Knöllchen siedeln sich Bakterien an. Diese Stickstofffixierung ermöglicht ein gutes Wachstum auf kargen Böden, kann aber auch zur Gründüngung eingesetzt werden. Die entsprechenden Enzyme sind die Nitrogenasen, die komplex gebundene Metallatome wie Eisen und Molybdän enthalten. In Form von Ammoniumsalzen (RNH4; R = Rest) oder Nitraten steht der gebundene Stickstoff über den Boden dann auch anderen Organismen zur Verfügung.
Technisch wurden wichtige Verfahren zeitnah zueinander entwickelt. Mit dem Linde-Verfahren gelang es, Stickstoff etwa seit dem Jahr 1903 direkt aus der Luft zu gewinnen. Bis heute ist es als Schutzgas und für Kühlzwecke von Bedeutung, da es unter Druck verflüssigt transportfähig ist und bei –173 °C verdampft.
Der zweite wichtige Schritt war das Haber-Bosch-Verfahren, mit dem seit 1913 Ammoniak aus Stickstoff herstellt wird. Schließlich sind mit dem Oswald-Verfahren auch Nitrate zugänglich. Damit eröffneten die deutschen Chemiker Carl Bosch, Fritz Haber, Alwin Mittasch, Wilhelm Oswald und Carl von Linde den Weg zu Düngemitteln – und explosiven Stoffen.
Dünger und Explosivstoffe
Der Kunstdünger wurde kurz vor Ausbruch des ersten Weltkrieges industriell zugänglich. Der ausbrechende Krieg lenkte die Produktion dann zur Produktion von Waffenmunition. Die zivile Nutzung der genannten Verfahren hatte erst in den 1960-er-Jahren ihre Blütezeit leistet bis heute einen immensen Beitrag zur Ernährung der Weltbevölkerung. Davor wurden biologisch verfügbare Dünger verwendet. Das bei militärischen Offensiven eingesetzte Schwarzpulver und andere Sprengstoffe basieren in ihrer Zusammensetzung auf Salpetersäure. Alfred Nobel machte Nitroglycerin zu einem sicher handhabbaren Sprengstoff und die Erfindung des Dynamit verschaffte ihm den Grundstock zu einem großen Vermögen.
Historisch lieferte der Stickstoff mit seinen Verbindungen also reichlich Material für spannende Forschung und Geschichten. Aktuell im Fokus sind die gasförmigen Stickoxide NOx, die vor allem aus Abgasen stammen. Sie reizen die Atemwege und bauen in der Atmosphäre Ozon ab. Daher werden Wege gesucht, sie zu reduzieren.
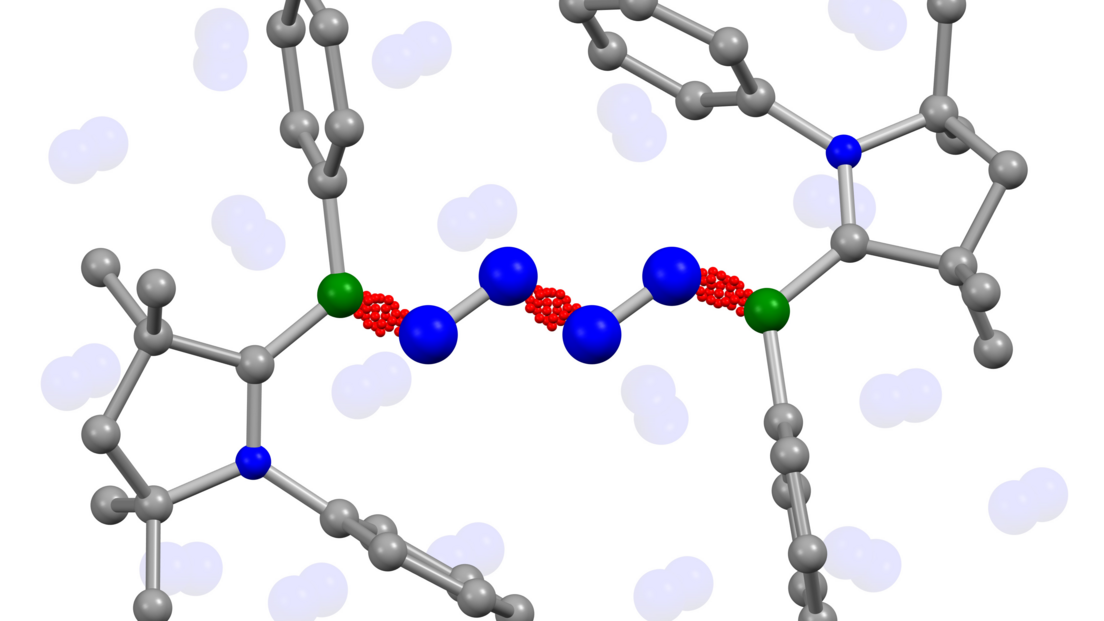
Verkettung
Gänzlich neue Reaktionen des Stickstoffs haben Forschende an der Julius-Maximilians-Universität Würzburg und der Goethe-Universität Frankfurt im Blick. Sie verketten Stickstoff-Moleküle zu langen Ketten, eine Reaktion die sonst nur aus dem Weltall bekannt ist. Kurze Ketten von Stickstoffmolekülen werden hingegen bereits in Medikamenten eingesetzt, die die Blutgefäße erweitern. Um zwei Stickstoff-Moleküle zu einer N4-Kette zu verknüpfen, werden Bor-haltige Moleküle benötigt. Die Reaktion erfolgt bei einem Druck von vier Bar, was technisch leicht umsetzbar ist. Die Bindungen werden am Computer simuliert, so lassen sich auch neue Synthesewege entwerfen, die etwa die Ketten in organische Moleküle integrieren. Eine Besonderheit ist, dass sich auch 15N-Isotope integrieren lassen, also Stickstoff-Atome mit einem zusätzlichen Neutron. Diese speziellen Verbindungen sind interessant für die Medizin und Pharmazie. Darüber hinaus ist es eine spannende Frage, wie lang die verknüpften Ketten werden können.
Literatur
Zum Artikel der aktuellen Forschung: Link
Originalpublikation in Science (auf Englisch und nur mit Zugang): Link
Umfassend, vor allem historisch spannend:
Ertl, Gerhard; Soentgen, Jens (2015): Stickstoff – ein Element schreibt Weltgeschichte. ISBN 978-3-86581-736-5
